- 首页
- 我们的服务
-
华微检测动物实验中心已通过广东省科技厅组织的实验动物许可证现场评审(屏障环境和普通环境),获得实验动物使用许可证。通过CMA资质认证,涉及领域涵盖医疗器械、消毒产品、化妆品、药包材、药品、化学品的毒理试验。 动物实验中心一期建设面积逾800m2的实验动物服务平台。现已功能涵盖了动物饲养、实验、动物模型和药物研究等,其中屏障环境实验设施能同时容纳6000余只大、小鼠进行实验,配备独立通风IVC系统,普通环境能同时开展兔、豚鼠、地鼠等动物实验。动物实验中心还配备有笼盒笼架清洗机、洗瓶机、垫料倾倒机、全自动灌瓶机、动物饮用水微电解灭菌系统、真空脉动灭菌器、全身全相态吸入毒性染毒仪等先进的仪器设备。
-
华微检测作为专业的生物降解性评估机构,配备全自动生物降解测试仪、电感耦合等离子体质谱仪、原子吸收分光光度计、总有机碳仪等多台高精尖设备,能为塑料制品提供公正、科学、准确的检测数据。
- 新闻资讯
- 检测流程
- 下载中心
- 关于我们
- 联系我们
 病毒清除工艺验证服务平台
病毒清除工艺验证服务平台病毒清除工艺验证服务
一、强检要求
为保证生物制品安全性,根据《中国药典》(2020年版)和《药品注册管理办法》的要求,由人或动物的组织、体液提取的制品、动物源性单克隆抗体及真核细胞表达的重组制品,应增加病毒清除工艺验证。
二、服务优势
华微检测配备有多间加强型生物安全二级实验室 (BSL-2),已通过广州市备案,实验室严格按照CNAS 、CMP及ISO9001要求的质量体系进行设计和管理,可为生物药创新研发和申报提供种类齐全的生物安全检测服务。
三、病毒安全性控制的一般性原则
1. 风险评估:生物制品的病毒安全性控制要求,应建立在风险评估的基础上结合产品特点综合考虑。
2. 全过程控制:控制体现在全过程,包括使用的原料/辅料来源控制、病毒筛查或处理等生产工艺对病毒的清除作用以及对产品病毒污染。
3. 全生命周期管理:生产工艺变更时须加以评估和确认,必要时还应通过上市后监测追溯产品病毒安全性。
4. 分类控制特点:
人血液制品:人血浆来源风险控制、病毒清除能力;
动物体液/组织来源制品:起始原料风险控制、病毒清除能力;
疫苗:病毒污染来源控制;
重组治疗性生物制品:病毒来源污染控制、病毒清除能力;
基因治疗产品:病毒污染来源控制。
四、病毒安全性控制的具体要求
1. 来源控制:起始原料、原材料及辅料;
2. 生产过程控制:产品生产工艺、特定病毒清除工艺步骤;
3. 产品病毒污染检测:病毒污染检测设置的原则、病毒污染检测方法的选择;
4. 病毒清除工艺验证:一般要求、用于病毒清除研究的检测方法、病毒清除效果的评估、统计分析、工艺变更对病毒清除的影响。
五、 病毒清除验证时间选择
工艺研发(R&D) → 新药临床申请(IND) → 上市许可申请(BLA) → 上市后补充验证 可选 强制 可选 强制 六、病毒清除验证常见工艺
常用的特定病毒清除工艺包括巴氏消毒法、干热法、有机溶剂/去污剂(S/D)处理法、膜过滤法、低pH孵育法、色谱法等。
1. 血液制品:S/D、干热灭活、除病毒过滤、巴氏消毒法
3. 医疗器械:辐射、强碱处理、氧化剂、分子交联
2. 生化药品:强碱处理、低pH孵育、高温、层析、超滤
4. 生物制品:低pH孵育、S/D孵育、层析、除病毒过滤
七、病毒清除验证常用指示病毒示例及相关属性
病毒 科 属 天然宿主 基因组 包膜 大小(nm) 形状 耐受性 水泡性口炎病毒(VSV) 弹状病毒 水泡性病毒 马、牛 RNA 有 70×175 子弹状 低 副流感病毒(PIV) 副粘液病毒 副粘液病毒 多种 RNA 有 100-200 多面体/球形 低 鼠白血病病毒(MuLV) 逆转录病毒 C型肿瘤病毒 小鼠 RNA 有 80-110 球形 低 辛德比斯病毒(SbV) 披盖病毒 阿尔发病毒 人 RNA 有 60-70 球形 低 牛病毒性腹泻病毒(BVDV) 披盖病毒 瘟病毒 牛 RNA 有 50-70 多面体/球形 低 伪狂犬病毒(PRV) 疱疹病毒 水痘病毒 猪 DNA 有 120-200 球形 中 脊髓灰质炎病毒I型Sabin株(PV-I) 小RNA病毒 肠道病毒 人 RNA 无 25-50 二十面体 中 脑心肌炎病毒(EMCV) 小RNA病毒 心病毒 小鼠 RNA 无 25-30 二十面体 中 呼肠孤病毒3型(Reo-3) 呼肠孤病毒 正呼肠孤病毒 各种 RNA 无 60-80 球形 中 猿猴空泡病毒40(SV40) 多瘤病毒 多瘤病毒 猴 DNA 无 40-50 二十面体 很高 人类免疫缺陷病毒(HIV) 逆转录病毒 慢病毒 人 RNA 有 80-100 球形 低 甲型肝炎病毒(HAV) 小RNA病毒 肝炎病毒 人 RNA 无 25-30 二十面体 高 细小病毒(犬、猪)(CPV、PPV) 细小病毒 细小病毒 犬、猪 DNA 无 18-24 二十面体 很高 注:有些病毒可能会对从事研究的人员造成健康损害,对此应加以重视; 以上只是一些病毒的举例,并不强制使用。
耐受性:指清除工艺研究中,对物理化学处理具有的耐受能力。耐受性与特定的处理有关,只有在了解病毒生物学特性和清除工 艺性质的情况下才能使用。实际情况会随着处理情况而变化。
八、病毒清除验证法规要求
1. ICH Q5A (R1): Viral Safety Evaluation of Biotechnology Products Derived From Cell Lines of Human or Animal Origin. 人用药品注册技术要求 国际协调会,1999
2. 血液制品去除/灭活病毒技术方法及验证指导原则。 国家食品药品监督管理局,2002
3. 生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则。国家食品药品监督管理总局 药品审评中心,2005
4. ISO 22442-3: Part 3: Validation of the elimination and/or inactivation of viruses and transmissible spongiform encephalopathy (TSE) agents. 国际标准化组织,2007
5. CHMP/BWP: Guideline on virus safety evaluation of biotechnological investigational medicinal products. 欧洲药 品管理局,2008
6. 多组分生化药注射剂基本技术要求。国家食品药品监督管理总局,2008
7. YY/T 0771.3-2009: 动物源医疗器械 第3部分:病毒和传播性海绵状脑病 (TSE) 因子去除与灭活的确认。 国家食品药品监督管理总局,2009
8. 同种异体植入性医疗器械病毒灭活工艺验证技术审查指导原则,国家食品药品监督管理总局,2011
9. EMA Guideline on the adventitious agent safety of urine-derived medicinal products. 欧洲药品管理局,2015
10. 药品生产质量管理规范,生化药品附录。国家食品药品监督管理总局,2017



九、病毒清除验证灭活动力学曲线
干热灭活病毒动力学曲线 低pH灭活病毒动力学曲线 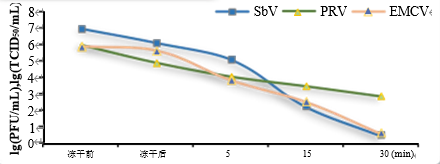
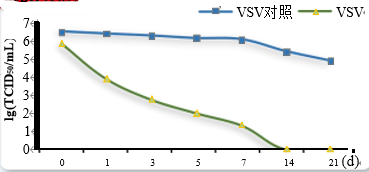
十、 病毒清除验证仪器设备
AKTA纯化仪 高效液相色谱仪 超高速离心机 


病毒清除工艺验证服务
联系方式:19128209916 吴工
版权所有 © 广东省华微检测股份有限公司

扫码关注“华微检测”
联系人:严工
联系电话:19924323595 020-82118257/82180804
地址:广州市黄埔区揽月路3号F栋106(总部)广州市黄埔区科学城尖塔山路1号(动物中心)
- 医药分析检测
- 医疗器械检测
- 病毒检测服务
- 实验动物服务
- 保健食品分析检测
- 生物制品服务工作站
- 仪器设备共享平台
- 分子生物学检测服务
- 生物安全检测服务
- 细胞功能研究服务
- 生物降解塑料分析检测




 立即咨询
立即咨询 留言咨询
留言咨询






















